コルヒチン0.2μg/ml〜1μg/ml(10^-4 Mは40μg/ml)又は、コルセミド0.05μg/ml〜0.2μg/ml添加。
37℃で1時間〜6時間処理(倍加時間によって調節)
(固定液は当日作ること)
滴下して、点火乾燥するのが一番簡単できれいな標本ができるが、Cバンドは加熱標本では作れない。
1m位上から滴下、または冷保存(−20℃)のスライドグラスに滴下するなどの方法では加熱の必要がない。
固定液が酸性なので、染色体は赤く染まる。
グリーンのフィルターをかけて鏡検する。
染色体の標本作製の文献を調べると方法が少しずつ違います。
たとえば、固定液は メチルアルコール 1 : 酢酸 1
2 : 1
3 : 1
低張液との混合比は 低張液 1 : 固定液 0.5
1 : 1
1 : 10
といった具合です。
結局、自分の使う細胞ではどの条件が一番適しているかを経験的に割り出して下さい。
標本が出来たら封入して、顕微鏡写真をとり、焼き付けて染色体核型の分析をします。
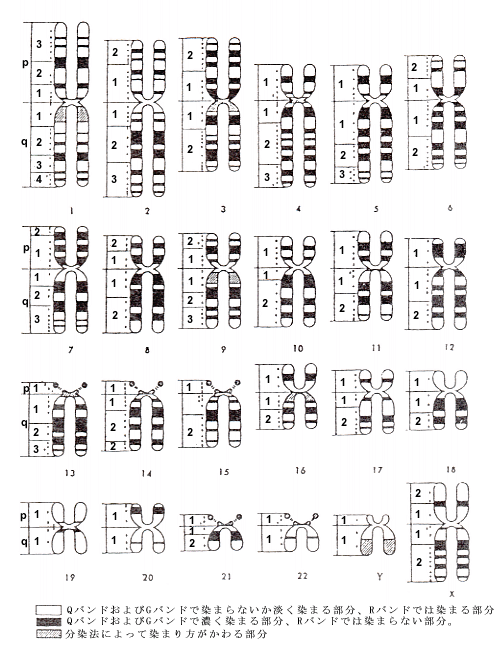
ヒト染色体の分析法の参考図「大きさと形による分類法」「分染法を用いた分類法」をつけておきます。
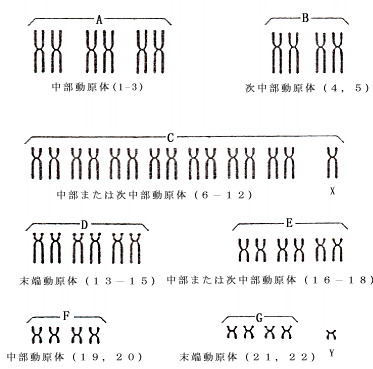
「ヒト染色体の大きさと形による分類法」
「ヒト染色体の分染法を用いた分類法」