ヒト単一染色体含有ライブラリ A9シリーズ細胞株の培養法
食品薬品安全センター
秦野研究所・変異遺伝部
中川ゆずき
1 培地器具等準備
1. 培養培地
ダルベッコ変法イーグル培地(Dulbecco's Modified Eagle's Medium = DMEM, Nissui, cat.05919)9.5g を2回蒸留水1Lに溶解し、オートクレーブ滅菌して使用。使用前に、10%炭酸水素ナトリウム水溶液(粉末でオートクレーブ滅菌し、滅菌蒸留水に溶解)を1Lあたり37mL加える(上記の条件では、pH調整は特に必要ない)。
また、グルタミン(Nissui, Cat. 05908 )0.3gを10mLの滅菌蒸留水に溶解して1L あたり10mL添加する。必要に応じて、ペニシリン・ストレプトマイシン(Gibco, cat.15140-122) を培地1Lあたり10mL加えてもよい(我々は添加していない)。
2. 血清
子ウシ血清(Calf serum, CS)を10%添加する。 血清の品質には、こだわらなくて良い。
3. 特定染色体の維持に必須な選択薬剤と使用法
A9(Neo)
10 mg/mL GENETICIN (neoGibco BRL, Cat. 11811-031)、 0.1 mM Hepes (Sigma, H-7006 )のDMEM溶液を作成し、pHを7.2に調整後、0.22umのフィルターで濾過滅菌してストック液とする。
培養時に培地に添加して最終濃度0.8mg/mLとする。培地に添加後、4℃保存で1ヶ月程度は使用可能。ストック液は-20℃で数ヶ月は凍結保存できる。
A9(Hygro)
Hygromycine B (hygroSigma, Cat. H-7772)を培地に1 mg/mLの濃度で溶解し、0.22umの フィルターで濾過滅菌して用いる。失活が早いので、用時調製し、溶解後1週間以内に使い切る。
A9(Bsr)
Blasticidine S hydrochloride (bsrフナコシ, Cat. 92-1) を100ug/mLの濃度でDMEMに溶解し、0.22umのフィルターで濾過滅菌してストック液とする。培養時に培地に添加して最終濃度3ug/mLとする。
培地に添加後、4℃保存で3週間程度は使用可能。ストック液も4℃で3週間程度は凍結保存できる。
CHO(His)
0.5M L-Histidinol (hisSigma, Cat. H-6647)、 0.1 mM HEPES (Sigma, H-7006 ) の DMEM 溶液を作成し、0.22umのフィルターで濾過滅菌して添加液とする。培養時に用時調製して培地に添加し、最終濃度を10mMとする。
失活が早いので、溶解後3日以内に使い切る。
(*:上記重量は全て実重量であり、力価重量ではない。)
4. 培養器具
特別な培養器具を用いる必要はないが、一部、接着性がやや弱い株があるので、場合によっては、メーカー等を検討する必要がある可能性もある。細胞バンクでは、Nunc社製の150 mm 組織培養用ディッシュ(Cat. 168381)、90 mm 組織培養用ディッシュ(Cat. 150350)を用いている。
2 継代培養法
ヒト単一染色体ライブラリ細胞に含まれるヒト染色体は、継代培養によって脱落、再構成を生じるので、解凍後なるべく少ない継代数で実験に供するのが望ましい。数次にわたって実験に用いる場合は、低継代数の凍結保存アンプルを必要数用意しておき、順次解凍して用いるのがよい。
長期に渡って培養を継続する必要がある場合は、数継代に1回程度、染色体保持率を検査する。
継代法は、一般的な細胞と同じであるが、細胞密度が高すぎるとヒト染色体の脱落が生じ易いので、視野率にして70%程度を目安として継代を行う。細胞倍加時間は株により大きく異なるが、早いものでは8-9時間程度なので、over growthしないように注意する。
細胞株によって増殖速度は異なるので、注意すること。培養の条件は一般的な培養条件とほぼ同じで、37℃の炭酸ガスインキュベーター(5% CO2)を加湿して用いる。
細胞の剥離は、ダルベッコPBS(-)(Nissui, Cat. 05913)で1回リンスし、0.01% EDTAを加えた0.25%トリプシン(Gibco, Cat. 15050-065)を用いて剥離する。5x105細胞/90mm ディッシュ程度を目安に継代する。
1. 解凍培養の開始
細胞の解凍後培養を開始する時には、選択薬剤を含まない培地を用いる。解凍培養にあたっては、1 ×104/cm2程度で植え込んで培養を開始する。解凍培養開始後翌日か翌々日から選択培地を用いる。
細胞培養にあたってはオーバーコンフルエントになってしまうことや、細胞の播き込み濃度を薄くしすぎること以外は、特に難しいことは無い。
2. 凍結保存
該当細胞の凍結保存にあたっては、細胞培養終了後遠心によって細胞を集めた後、選択薬剤を含まない培地に1×106/mLの濃度で懸濁して細胞を浮遊させてから、10%の濃度となるようにDMSOを加えてアンプル(セラムチューブ)に分注して緩慢凍結する(-1℃/分)。
長期保存には、液体窒素下に保存するのが望ましい。簡便法として、-80℃フリーザーに入れて一晩静置した後液体窒素タンクに保存する方法も利用できる.
3. 染色体保持率の検査
空気乾燥法あるいは火炎法で染色体標本を作成し、キナクリン・ヘキスト2重染色法で核型解析を行う。
ペインティングプローブを用いた蛍光in situ hybridization法でも保持率の検査は可能であるが、欠失等の再構成の検出が難しいので、核型解析と組み合わせて行うのが望ましい。
[Close]Information for the timing of selection.
The selection reagents should not be added at the initiation of culture, but should be added AFTER the growth of cell line is confirmed.
Selection can be done 1-2 days after thawing (please certain that the cells are healthy before changing to selection media).
If selection reagents were added immediately after thawing, there is a risk for the failure of survival.
[Close]
[ヒト単染色体導入ハイブリッド細胞の分譲について:鳥取大とのMTA締結が必要です]
当該細胞株は、利用者と鳥取大学との間で個別にMaterial Transfer Agreement (MTA) を取り交わすことが分譲の条件となりました。MTAは、基本的にアカデミアは無償、企業は有償の内容となると伺っていますが、個別案件となり、バンクはMTAの内容に関与することができません。
従って、細胞の分譲をご希望される方は分譲の依頼に先立ち、下記、香月先生に連絡して鳥取大との間でMTAを取り交わし、そのコピー(契約が成立したことがわかる部分)を添付してJCRB細胞バンクに分譲依頼を行ってください。
なお、香月先生に連絡をする際、JCRB番号、細胞名、研究(使用)目的を明確にお伝えください。
連絡先:
〒683-8503 鳥取県米子市西町86
鳥取大学染色体工学研究センター
香月 康宏 (教授)
TEL: 0859-38-6212
FAX: 0859-38-7514
メールアドレス: kazuki@tottori-u.ac.jp
分譲は、MTAが締結され、分譲依頼書・同意書の研究目的と齟齬がないことが確認されたうえで実施されます。
[Close]
[About the distribution of human monochromosomal hybrid cells: Requirement of MTA between customers and Tottori University]
The distribution of human monochromosomal hybrid cell lines developed by Dr. Oshimura, Tottori University, needs to conclude MTA (material transfer agreement) between users and Tottori University. In principle, the MTA will include the licensing fee if the user's affiliation is profit-making organization and without charge if the user is belonging to academia. However, the terms and condition of MTA may change by cases. JCRB Cell Bank can not mediate the MTA.
Therefore, prior to the ordering to JCRB Cell Bank please contact to Tottori University and conclude MTA with Tottori University. When you contact to Tottori University, please clarify the JCRB number, name of cell line and intended use of cells.
At the ordering to JCRB Cell Bank, please send us the copy of MTA with Request and Agreement Form (Form A).
[Contact information of Tottori University]
Dr. Yasuhiro Kazuki
Tottori University
Chromosome Engineering Research Center
86 Nishimachi, Yonago-shi
Tottori 683-0826, Japan
TEL: +81-859-38-6212
FAX: +81-859-38-7514
E-mail Address: kazuki@tottori-u.ac.jp
After checking that the research purpose in Form A is consistent to the MTA, JCRB will start to process the order.
[Close]
| JCRB No. |
JCRB2211 |
Cell Name |
A9(neo11) |
| Profile |
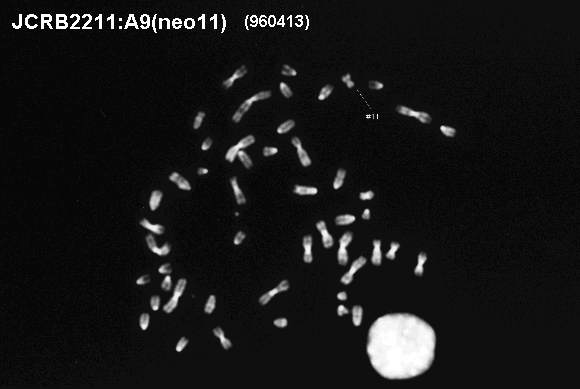
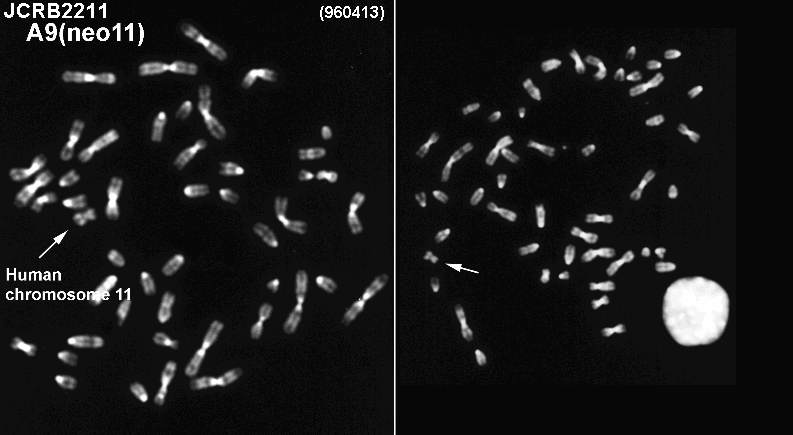
contains human chromosome #11 (MTA with Tottori Univ. is required.) |
Other Name |
A9 |
| Animal |
human chromosome-introduced |
Strain |
C3H |
| Genus |
Mus |
Species |
musculus |
| Sex |
|
Age |
|
| Identity |
|
Tissue for Primary Cancer |
human monochromosomal hybrid panel |
| Case history |
|
Metastasis |
No |
| Tissue Metastasized |
|
Genetics |
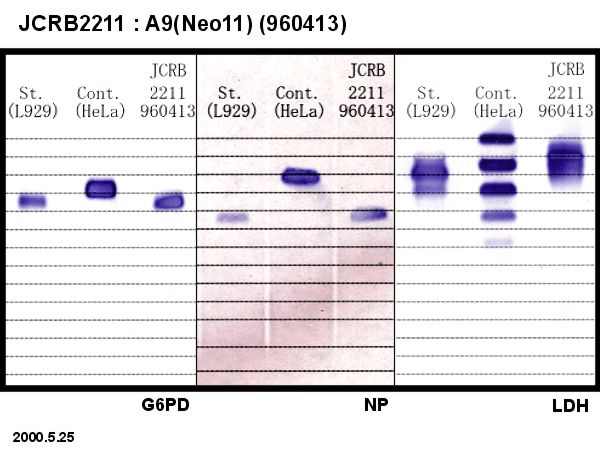
91.5% cells included intact human chromosome #11 at deposit. |
| Life Span |
infinite |
Crisis PDL |
|
| Morphology |
fibroblast-like |
Character |
skin fibroblast, AG-r. Cells include human chromosome #11. |
| Classify |
panel |
Established by |
Oshimura,M. |
| Registered by |
Oshimura,M. |
Regulation for Distribution |
MTA with Tottori Univ. is required. |
| Comment |
Human chromosome was selected by G418. Tagged site 11p11. The human chromosome #11 is derived from the cell line MRC-5. |
Year |
1995 |
| Medium |
Ducbecco's modified Eagle's medium with 10% calf serum, 0.8mg/ml G418 & Penicillin-Streptmycin. |
Methods for Passages |
Cells are treated with 0.25% trypsin. |
| Cell Number on Passage |
5.7x10^4cells/5ml/25 flask . |
Race |
|
| CO2 Conc. |
5 % |
Tissue Sampling |
skin |
| Tissue Type |
|
| Reference |
| Pubmed id:10919723 | Human monochromosome hybrid cell panel characterized by FISH in the JCRB/HSRRB.
Tanabe H,Nakagawa Y,Minegishi D,Hashimoto K,Tanaka N,Oshimura M,Sofuni T,Mizusawa H
Chromosome Res. 2000;8(4):319-34
|
|---|
| Pubmed id:1639397 | Ordering of human chromosome 3p markers by radiation hybrid mapping.
Tamari M,Hamaguchi M,Shimizu M,Oshimura M,Takayama H,Kohno T,Yamaguchi N,Sugimura T,Terada M,Yokota J
Genomics. 1992 Jul;13(3):705-12
|
|---|
| Pubmed id:1723716 | Human complement regulatory proteins expressed on mouse A9 cells containing a human chromosome 1.
Seya T,Okada M,Hara T,Matsumoto M,Miyagawa S,Oshimura M
Immunology. 1991 Dec;74(4):719-24
|
|---|
| Pubmed id:1995301 | Introduction of new genetic markers on human chromosomes.
Satoh H,Barrett JC,Oshimura M
Exp Cell Res. 1991 Mar;193(1):5-11
|
|---|
| Pubmed id:1978855 | Establishment of a novel immortalized cell line from ataxia telangiectasia fibroblasts and its use for the chromosomal assignment of radiosensitivity gene.
Ejima Y,Oshimura M,Sasaki MS
Int J Radiat Biol. 1990 Dec;58(6):989-97
|
|---|
| Pubmed id:2267132 | Suggestive evidence for functionally distinct, tumor-suppressor genes on chromosomes 1 and 11 for a human fibrosarcoma cell line, HT1080.
Kugoh HM,Hashiba H,Shimizu M,Oshimura M
Oncogene. 1990 Nov;5(11):1637-44
|
|---|
| Pubmed id:1702413 | Normal human chromosome 1 carries suppressor activity for various phenotypes of a Kirsten murine sarcoma virus-transformed NIH/3T3 cell line.
Yamada H,Horikawa I,Hashiba H,Oshimura M
Jpn J Cancer Res. 1990 Nov;81(11):1095-100
|
|---|
| Pubmed id:2392323 | Multiple chromosomes carrying tumor suppressor activity for a uterine endometrial carcinoma cell line identified by microcell-mediated chromosome transfer.
Yamada H,Wake N,Fujimoto S,Barrett JC,Oshimura M
Oncogene. 1990 Aug;5(8):1141-7
|
|---|
| Pubmed id:2502516 | Construction of mouse A9 clones containing a single human chromosome tagged with neomycin-resistance gene via microcell fusion.
Koi M,Shimizu M,Morita H,Yamada H,Oshimura M
Jpn J Cancer Res. 1989 May;80(5):413-8
|
|---|
| Pubmed id:2498246 | Construction of mouse A9 clones containing a single human chromosome (X/autosome translocation) via micro-cell fusion.
Koi M,Morita H,Shimizu M,Oshimura M
Jpn J Cancer Res. 1989 Feb;80(2):122-5
|
|---|
| Pubmed id:14213660 | THREE DEGREES OF GUANYLIC ACID--INOSINIC ACID PYROPHOSPHORYLASE DEFICIENCY IN MOUSE FIBROBLASTS.
LITTLEFIELD JW
Nature. 1964 Sep 12;203():1142-4
|
|---|